Распространенность запоров в россии
Запором считают хроническую (более 48 ч) задержку опорожнения кишечника или затруднение дефекации при сохранении нормальной периодичности стула. Функциональным считают запор, если отсутствует его связь с известными генетическими, структурными или иными изменениями кишечника.
В западных странах хронический запор широко распространен – им страдают от 2% до 27% населения [13]. Запор отмечается у примерно 12% населения мира, при этом жители Америки и стран Юго-Восточной Азии страдают им в 2 раза чаще, чем европейцы (17,3 и 8,75% соответственно) [4]. Эти цифры не являются истинными, поскольку многие пациенты не обращаются к врачу, надеясь, что запор разрешится сам (не считая тех, кто неудовлетворен результатами лечения). В России подобная статистика отсутствует, но средние цифры, которые публикуются в различных отчетах, примерно такие же, как представленные.
Широкая распространенность запоров дала основание отнести это расстройство к болезням цивилизации.
Нормальная периодичность стула – показатель, индивидуальный для каждого человека, при этом принято считать, что у практически здоровых людей нормальная периодичность стула колеблется от 1–3-х раз в сутки до 1 раза в 3 дня (5–7% обследованных) [10]. Как правило, такие особенности носят наследственный характер.
В настоящей работе мы рассмотрим в основном функциональные запоры (ФЗ), которые являются компетенцией терапевтов и гастроэнтерологов. Органические запоры, как правило, являются острой ситуацией, находящейся в компетенции хирургов. При первичном рассмотрении характера запора (ФЗ или органический) мы должны пользоваться международными критериями (Римские критерии III, 2006), согласно которым должны присутствовать 2 или более из числа следующих признаков:
– редкая эвакуация содержимого кишечника (менее 3–х дефекаций в неделю);
– отхождение при дефекации малого количества кала (<35 г/сут);
– отхождение плотного, сухого кала, фрагментированного по типу «овечьего», травмирующего область заднепроходного отверстия (признак должен встречаться чаще, чем в 1/4 актов дефекации);
– ощущение чувства блокирования содержимого в прямой кишке при потугах (аноректальная обструкция);
– не менее 25% времени акта дефекации сопровождается натуживанием, иногда возникает необходимость удаления содержимого из прямой кишки при помощи пальца, поддержки пальцами тазового дна (чаще, чем в 1/4 актов дефекации).
Запор считается функциональным и хроническим, если его симптомы появились по меньшей мере за 6 мес. до момента диагностики и сохраняются на протяжении не менее 3-х мес., необязательно непрерывных, отсутствуют достаточные критерии для диагностики синдрома раздраженного кишечника, самостоятельный стул редко возникает без использования слабительных средств.
Основным патогенетическим механизмом развития ФЗ является нарушение моторной функции толстой кишки, связанное со снижением скорости продвижения кишечного содержимого при отсутствии анатомических аномалий (медленно – транзитный запор или инертная толстая кишка). Среди других факторов, формирующих ФЗ, можно выделить: а) повышенное всасывание воды в толстой кишке, б) неспособность пациента произвести акт дефекации, в) отсутствие у больного позывов к дефекации, что указывает на нарушение чувствительности рецепторного аппарата аноректальной зоны кишки, выполняющей функцию накопления и эвакуации каловых масс.
Кроме хронических выделяют «временные» запоры, причинами развития которых являются:
– изменение условий быта;
– изменение характера питания и пищи;
– изменение комфортных условий для дефекации («запоры путешественников»);
– эмоциональный стресс;
– беременность (с закономерным изменением гормонального статуса);
– постельный режим;
– прием лекарственных препаратов, изменяющих моторику толстой кишки.
Выделение этой группы запоров имеет важное клиническое значение, т. к. понимание причины и объяснение ее пациенту (особенно с тревожно-мнительным характером) может снять психоэмоциональное напряжение и разрешить ситуацию в целом.
Так как рассматриваемый хронический запор носит функциональный характер, то диагноз ставится методом дифференциальной диагностики с исключением в первую очередь заболеваний (или клинических ситуаций), протекающих с запором и связанных:
– с образом жизни (недостаточное употребление пищевых волокон, малый объем принимаемой пищи и жидкости, низкая физическая активность);
– с воздействием внешних факторов (побочное действие лекарственных препаратов (ятрогенные запоры));
– с эндокринными и метаболическими нарушениями (гипотиреоз, гиперкальциемия, порфирия, амилоидоз);
– с неврологическими факторами (паркинсонизм, рассеянный склероз, нарушение функций спинного мозга, нарушение парасимпатической иннервации из крестцового сплетения, автономная нейропатия при сахарном диабете (синдром кишечной псевдообструкции));
– с психогенными факторами (эмоциональные перегрузки, стресс, депрессия, анорексия, навязчивые идеи «внутренней чистоты»);
– с гастроэнтерологическими заболеваниями (нарушение кишечной проходимости в результате стриктуры, обструкции опухолью или инородным телом, внешнего сдавления (спаечная болезнь), врожденный аганглиоз (болезнь Гиршпрунга), долихосигма, миопатии, нейропатии различного генеза, системная склеродермия с поражением кишечника, синдром раздраженного кишечника (вариант с преобладанием запоров), глистная инвазия;
– с патологией органов аноректальной зоны (стеноз анального канала, слабость тазового дна, опущение промежности, асинергия тазового дна, ректоцеле больших размеров, пролапс прямой кишки, язва прямой кишки).
Диагностика
Обследование больного с запором должно включать тщательный расспрос и осмотр, оценку образа жизни, сбор лекарственного анамнеза, пальцевое исследование per rectum, исследование общего и биохимического анализа крови, копрограммы. Полученные данные определяют алгоритм дальнейшего обследования. Выявление «симптомов тревоги» (астенические проявления, лихорадка, похудение, анемия, повышение СОЭ, наличие крови в кале) делает необходимым проведение эндоскопического/рентгенологического исследования кишечника.
Эта часть диагностического процесса помогает провести дифференциальную диагностику со вторичными и ситуационными формами запора, а сама диагностика с учетом разнообразия причин и механизмов развития запора при первом обращении больного должна быть поэтапной [6]:
1-й этап:
• Оценка клинических данных (соответствие жалоб пациента принятым критериям запоров).
• Рентгенологическое исследование кишечника, позволяющее оценить анатомическое состояние толстой кишки (либо ее нормальное строение, либо аномалии положения, идиопатический мегаколон, опухоли, стриктуры, болезнь Гиршпрунга, спаечная болезнь).
2-й этап:
• Колоноскопия с биопсией слизистой оболочки для уточнения или исключения структурных изменений.
• Оценка состояния, в т. ч. и функционального, других органов и отделов ЖКТ, эндокринных параметров, влияющих на моторику кишечника. Для женщин обязателен осмотр гинекологом с целью определения положения матки. После установления статуса больной передается специалисту, а функциональные расстройства кишечника рассматриваются как вторичные.
3-й этап:
• Специальные методы исследования, позволяющие оценить моторно-эвакуаторную функцию толстой кишки, состояние запирательного аппарата прямой кишки (электромиография, изотопное исследование, анальная манометрия, исследование микробного статуса, короткоцепочечных жирных кислот (КЖК) в кале, изучение электролитного баланса).
Выполнение программы обследования позволит ответить на основной вопрос: вызван ли запор органической патологией (и тогда больной передается конкретным специалистам) или носит функциональный характер, и тогда им будет заниматься либо терапевт, либо гастроэнтеролог. Так как диагноз функциональных заболеваний на сегодняшний день ставится методом исключения, то выполнение программы обследования обязательно. И только после того, как диагностика осуществлена, определены формы, подлежащие хирургическому лечению, привлечены к лечению эндокринолог, гинеколог, психотерапевт, проводится длительное лечение у терапевта или гастроэнтеролога.
Лечение
Основные принципы лечения ФЗ:
– после уточнения характера питания проводится коррекция диеты (изменяются объем и характер питания, регулируется водный баланс);
– коррекция образа жизни, в основном физической активности (в соответствии с возрастом и активностью кишечника);
– лечение основного заболевания, вызвавшего запор или способствовавшего его возникновению;
– коррекция негативных медикаментозных влияний (отмена препарата, изменение дозы, замена на препараты другой патогенетической группы);
– физиотерапевтические процедуры (в отсутствие противопоказаний);
– нормализация моторной функции толстой кишки (прокинетики при гипокинезии или спазмолитики при гиперкинезии толстой кишки);
– применение слабительных средств.
Говоря о диетах, следует помнить, что причинами формирования ФЗ у детей раннего возраста являются:
– перевод на искусственное вскармливание;
– формирование пищевой аллергии (прежде всего на белки коровьего молока, нередко именно это бывает причиной запора и у взрослого);
– императивное воспитание туалетных навыков (у детей 1–2 лет);
– болезненность дефекаций с развитием «болезни горшка»;
– начало посещения детского учреждения;
– отсутствие комфортных условий для осуществления дефекации.
Эти положения нужно помнить и рассматривать их как важные при выборе лечения запоров у детей.
Диетические рекомендации взрослому пациенту с запорами строятся в зависимости от моторной функции толстой кишки. Так, при гипомоторной дисфункции рацион формируется по типу «шлаковой» нагрузки. Освобождению кишечника способствуют: овощи, фрукты (бананы, яблоки), ягоды, преимущественно сырые – не менее 200 г/сут; чернослив или курага (8–12 ягод); растительное масло (оливковое, кукурузное) – 1–2 ст. л. натощак (лучше размешать в кефире и принимать на ночь); гречневая, овсяная, ячневая, перловая каши; мед – 1 ст. л. 2–3 р./сут; пшеничные отруби (включены в сорта хлеба «Здоровье», «Барвихинский», «Докторский»). Количество жидкости следует увеличить до 1,5–2 л/сут. Целесообразно выпивать 1–2 стакана холодной воды (фруктового сока) утром натощак с добавлением 1 ст. л. меда или ксилита.
Из рациона следует исключить: рисовую, манную каши, макароны, вермишель, картофельное пюре, кисели, поскольку эти продукты тормозят опорожнение кишечника.
Вне зависимости от преобладающего типа моторики толстой кишки в рационе питания используют пищевые волокна (отруби, микрокристаллическую целлюлозу, мукофальк – семенную кожуру подорожника, псилиум – подорожник, морскую капусту, биологически активные добавки с высоким содержанием растворимых и нерастворимых волокон). Обязательным условием применения пищевых волокон является соблюдение увеличенного водного баланса, т. к. они адсорбируют воду, увеличивают количество бактериальной флоры, массы фекалий и изменяют миоэлектрическую активность кишечника, что приводит в равновесие пропульсивные и тонические сокращения мускулатуры толстой кишки. При разрушении пищевых волокон увеличивается образование КЖК, которые используются как трофический субстрат для энтероцитов (ацетат, пропионат). У пациентов пожилого и старческого возраста при наличии сердечной недостаточности эти рекомендации следует использовать с осторожностью.
При гипермоторной дисфункции диета более щадящая. Овощи употребляют в отварном виде, большое внимание уделяется растительным жирам. Пшеничные отруби назначаются в постепенно повышающихся дозах до оптимального количества, поддерживающего терапевтический эффект.
Рекомендации по коррекции образа жизни включают отсутствие утренней спешки, объемный завтрак, комфортабельный удобный туалет, удобную позу в туалете (с подтянутыми коленями, ноги на маленькой скамеечке), утреннюю гимнастику (движение Вальсальвы, имитация езды на велосипеде, самомассаж живота).
Лекарственная терапия направлена в первую очередь на регуляцию моторики. При этом следует помнить, что к развитию запора может приводить прием лекарственных препаратов, тормозящих моторику (холинолитики, спазмолитики с широким спектром действия, блокаторы гистаминовых рецепторов и др.). Следует тщательно собрать лекарственный анамнез и от каких-то групп препаратов отказаться, какие-то – заменить или уменьшить дозу. После того как проведена коррекция исходной фармакотерапии (вторично влияющей на моторику толстой кишки) и установлен тип расстройства моторики (гипотония, гипертония, расстройство моторики по смешанному типу), назначают регуляторы моторики ЖКТ. В разные периоды времени использовались следующие представители этой группы: домперидон, итоприд, тримебутин. Все они в среднетерапевтических дозах при курсовом лечении оказывались эффективными у 70–90% больных. Так как все они относятся к группе рецепторных, то при длительном лечении полученный эффект ускользает, что требует замены на регулятор моторики с иным механизмом действия.
Все слабительные средства можно разделить на 3 основные группы:
1. Увеличивающие объем кишечного содержимого:
– пищевые волокна,
– гидрофильные коллоиды (макроголи),
– осмотические: олигосахариды (лактитол, лактулоза, дюфалак); спирты (сорбит, глицерил); солевые слабительные (магнезия, глауберова соль и др.).
2. Стимулирующие:
– антрагликозиды (препараты сенны, крушины, ревеня),
– производные дифенилметана (бисакодил, дульколакс),
– пикосульфат натрия (Гуттасил).
3. Размягчающие фекалии (вазелиновое и другие минеральные масла).
У каждой из указанных групп препаратов есть свои достоинства и недостатки, и должна быть «своя» группа больных, характеризующаяся определенным типом расстройства моторики, возрастом, сочетанной патологией, характером расстройства микрофлоры и др.
Так, гидрофильные коллоиды обладают умеренно выраженным осмотическим действием и увеличивают объем кишечного содержимого. Недостатками их являются медленно развивающийся эффект, выраженная гипотония кишки. Препараты данной группы не показаны пациентам с проктогенными запорами.
Осмотические слабительные (сорбит, маннитол, глицерин) и солевые действуют на уровне тонкой кишки и способствуют большому выделению в просвет кишки жидкости, при этом возможны диарея, тканевая дегидратация и потеря электролитов. В настоящее время они используются в комплексной подготовке кишечника к исследованию.
Олигосахара (лактоза и ее производные) действуют только в толстой кишке, обладают двойным эффектом действия: увеличивают объем и являются бифидогенными и лактогенными пребиотиками, стимулируют бактериальный рост.
Стимулирующие обладают быстрым эффектом (иногда непредсказуемым), к ним быстро развивается привыкание, и возможны нежелательные явления, особенно у больных с сердечно-сосудистой патологией. Имея ограниченный срок использования, многие препараты требуют тщательного врачебного контроля. Так, метаболиты препарата сенны при длительном применении накапливаются в слизистой оболочке кишечника, нейронах ганглионарных сплетений, что ведет к дегенеративным изменениям гладкой мускулатуры с развитием «инертной толстой кишки». Метаболиты антрагликозидов гепато- и нефротоксичны, обладают мутагенным действием и не должны использоваться длительно, а тем более постоянно.
Пикосульфат натрия (Гуттасил) имеет ряд преимуществ перед препаратами из своей и других групп. Это контактное слабительное средство триариаметановой группы, которое активируется только в толстой кишке под действием бактериальных сульфатаз. Препарат стимулирует чувствительные нервные окончания слизистой оболочки, усиливая моторику. При курсовом лечении стимулирует рост и метаболическую активность нормальной (облигатной) микрофлоры кишечника. Обладает мягким предсказуемым эффектом, что дает пациенту возможность планировать свой день. Удобно и наличие 2-х форм выпуска: капель и таблеток.
Режим дозирования:
а) капли:
– взрослые и дети старше 10 лет – 13–27 капель;
– дети от 4-х до 7 лет – 7–13 капель;
– дети до 4-х лет – 2 капли на 3 кг веса;
б) таблетки (7,5 мг):
– взрослые и дети старше 10 лет – 1 таблетка в день, курс – 30 дней.
Ограничившись представленными сведениями [5–7], следует отметить, что использование слабительных средств при запорах – далеко не простое дело, и решение об их применении должно быть не началом фармакотерапии, а завершением ее выбора. Само же лечение следует проводить только под тщательным наблюдением терапевта или гастроэнтеролога.
Нарушение какого-либо принципа лечения запоров со стороны врача или больного ведет к неудовлетворенности пациента, использующего слабительные средства, могут отмечаться:
– слабый (недостаточный) эффект;
– чрезмерный эффект (неуправляемый стул);
– «ускользание» эффекта (возврат запоров) и др.
Все это ведет к тому, что начинается новый цикл работы с больным (обследование, отработка доз, смена слабительных, сочетанный вариант лечения). Гораздо легче проводить лечение слабительными под контролем врача, тогда эффективность этой терапии будет гораздо выше.
Успешное лечение запоров заключается в установлении причин их возникновения и правильном выборе программы лечения. Своевременная диагностика является залогом профилактики прогрессирования патологии толстой кишки и функционально зависящей от нее патологии органов ЖКТ.
Источник
Хронический запор является глобальной медико-социальной проблемой.
Согласно эпидемиологическим данным, эта патология поражает до четверти всей популяции экономически развитых стран и существенно влияет на качество жизни больных. Несмотря на высокую распространенность заболевания, пациенты крайне редко обращаются за медицинской помощью. В статье представлены современные данные об эпидемиологии, факторах риска, диагностических критериях и возможностях терапии хронического запора.
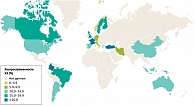
Рис. 1. Распространенность ХЗ в мире

Диагностические критерии хронического идиопатического запора (Римский консенсус IV пересмотра, 2016 г.)

Рис. 2. Бристольская шкала формы стула
Введение
Под термином «запор» понимают комплекс симптомов, связанных с уменьшением частоты актов дефекации (менее трех раз в неделю), изменением консистенции каловых масс (твердые, фрагментированные), избыточным натуживанием, а также ощущением неполного опорожнения прямой кишки [1, 2]. Принято выделять острый запор, длительность которого не превышает семи суток, и хронический запор (ХЗ), при котором продолжительность симптоматики превышает три месяца [2]. Именно последний тип представляет глобальную медико-социальную проблему и имеет высокую значимость для современной гастроэнтерологии. Во многом это обусловлено широкой распространенностью ХЗ в популяции, а также существенным негативным влиянием на качество жизни больных [3].
В настоящее время в зарубежной литературе ХЗ подразделяют на первичный и вторичный [2, 4]. К первичным относят запоры, обусловленные алиментарными (низкое потребление воды и клетчатки) и поведенческими факторами (низкая физическая активность), а также первичными нарушениями моторики толстой кишки и координации мышечного аппарата, обеспечивающих дефекацию. В свою очередь вторичный ХЗ обусловлен приемом медикаментозных препаратов, обладающих потенциалом в отношении индукции запора (опиоидные анальгетики, антидепрессанты, психотропные и противосудорожные средства, нейролептики и т.д.), или наличием у пациента ряда органических, системных и психиатрических заболеваний (колоректальный рак, дивертикулез толстой кишки, гипотиреоз, болезнь Паркинсона, рассеянный склероз, амилоидоз, расстройство пищевого поведения и др.) [2, 4]. Первичный ХЗ подразделяют на три основные группы:
- хронический идиопатический запор: запор с нормальным транзитом и синдром раздраженного кишечника с преобладанием запора (СРК-З);
- нарушения ректальной эвакуации: диссинергическая дефекация, инвагинация прямой кишки, синдром нисходящей промежности, выпадение прямой кишки и ректоцеле;
- запор с замедленным транзитом: мегаколон, связанный с болезнью Гиршпрунга, болезнью Шагаса, хронический идиопатический мегаколон и мегаколон, ассоциированный с синдромом множественной эндокринной неоплазии 2-го типа.
Большинство клинических случаев первичного ХЗ представлено хроническим идиопатическим запором, запором с нормальным транзитом [2, 3]. При этом типе ХЗ нейромышечная функция толстой кишки интактна, поэтому в литературе его нередко называют функциональным запором, что отражено в последних критериях Римского консенсуса IV пересмотра (2016 г.) [5, 6]. Хронический паттерн течения данного заболевания негативно влияет на качество жизни больных и сопряжен со значительными прямыми и косвенными экономическими затратами. Это обусловливает актуальность проблемы для современной клинической медицины [2, 3].
Эпидемиология и факторы риска
Сегодня тенденция к росту распространенности ХЗ отмечается не только в европейских странах, но и азиатском регионе, где в силу культурных особенностей питания запор еще до недавних пор был относительно редким явлением.
Крупнейший метаанализ 45 кросс-секционных социологических исследований на различных континентах продемонстрировал, что глобальная распространенность хронического идиопатического запора составляет 14% (рис. 1) [7]. В двух связанных между собой азиатских исследованиях, проведенных в Южной Корее, Китае и Индонезии, распространенность запора составила 15–23% среди женщин и приблизительно 11% среди мужчин [8, 9]. В экономически развитых странах ХЗ поражает до четверти всей популяции [7, 10]. В целом данное заболевание чаще выявляется в субпопуляциях с низким социально-экономическим статусом (отношение шансов (ОШ) 1,32; 95%-ный доверительный интервал (ДИ) 1,11–1,57) [7].
В ряде работ показано, что распространенность ХЗ среди женщин в среднем в два-три раза выше, чем среди мужчин [11, 12]. В указанном метаанализе общая распространенность ХЗ среди женщин почти в два раза превысила таковую среди мужчин (17,4% (95% ДИ 13,4–21,8) и 9,2% (95% ДИ 6,5–12,2); ОШ 2,22 (95% ДИ 1,87–2,62) соответственно) [7].
Сохраняется тенденция и в отношении возрастного ценза пациентов: распространенность констипации увеличивается до 50% среди лиц в возрасте старше 65 лет и до 74% к концу жизни [13, 14].
Систематизация трех исследований со сходным дизайном наглядно продемонстрировала этот тренд риска: ОШ 1,20 (95% ДИ 1,09–1,33) в возрасте 30–44 года, ОШ 1,31 (95% ДИ 1,09–1,58) в возрасте 45–59 лет и ОШ 1,41 (95% ДИ 1,17–1,70) в возрасте ≥ 60 лет [8, 9, 15].
При таком росте заболеваемости ХЗ переходит в разряд медико-социальных проблем, поскольку увеличивает не только прямые, но и косвенные затраты [16]. Именно поэтому вопросы рациональной диагностики и лечения ХЗ крайне важны для клиницистов.
Диагностика
Современный диагностический алгоритм ХЗ предполагает несколько этапов. Сначала необходимо идентифицировать признаки заболевания, согласно Римским критериям IV пересмотра (2016 г.) (таблица) [5, 6].
При расспросе пациента для объективизации консистенции и формы кала практикующему врачу целесообразно пользоваться бристольской шкалой (рис. 2) [17, 18]. При запоре процентное содержание воды в кале снижается до
Далее следует исключить СРК-З, а также выявить так называемые симптомы «красных флагов», указывающих на наличие органической патологии [16, 19]. Основным критерием дифференциальной диагностики ХЗ с СРК-З является наличие болевого абдоминального синдрома, весьма специфичного для СРК [6, 20]. При ХЗ также могут отмечаться эпизоды абдоминальной боли, но для СРК это облигатный признак [21, 22]. Однако не стоит забывать, что болевой абдоминальный синдром может наблюдаться и при органической патологии, способствующей развитию запора [16, 19, 21]. Для выявления указанных симптомов проводится скрининг на «красные флаги», такие как: гематохезис (наличие неизмененной крови в стуле);
- анемия;
- лихорадка;
- анорексия;
- потеря массы тела;
- появление симптомов в возрасте старше 50 лет;
- усиление запоров в возрасте старше 50 лет;
- патологические изменения объективного статуса, лабораторных показателей, инструментальных исследований;
- положительный тест на скрытую кровь;
- колоректальный рак и рак другой локализации у родственников;
- воспалительные заболевания кишечника у родственников;
- целиакия у родственников.
Отсутствие всех перечисленных симптомов «красных флагов» должно подтолкнуть врача к дальнейшему диагностическому поиску в целях идентификации генеза ХЗ. Так, для исключения вторичного ХЗ целесообразно проведение тщательного лабораторно-инструментального исследования. Речь идет о клиническом и биохимическом анализах крови, мочи, копрологическом исследовании или анализе кала на скрытую кровь, пальцевом исследовании прямой кишки, ректороманоскопии, колоноскопии; полипозиционной ирригоскопии с двойным контрастированием [3, 4, 23]. При выявлении вторичного генеза ХЗ помимо симптоматической терапии проводится лечение, направленное на разрешение основного заболевания. Для выбора адекватной тактики лечения нередко требуются консультации узких специалистов. В отсутствие вторичных причин ХЗ необходимо начинать эмпирическую терапию [2].
Лечение
Лечение ХЗ остается не самой простой задачей для клинициста по ряду причин [24]. В целом лишь 34% больных обращаются за медицинской помощью [25]. Как правило, пациенты обращаются к врачу с такой деликатной проблемой, как запор, уже тогда, когда возможность доступных средств исчерпана (безрецептурные слабительные в произвольном количестве и комбинациях, изменение рациона питания и злоупотребление очистительными процедурами). Длительный анамнез констипации и беспокоящей симптоматики, нарастающая тревога по поводу безуспешности проведенных мероприятий нередко становятся мотивирующим фактором первичного обращения к специалисту [24].
Первоочередным методом в рамках терапии ХЗ является модификация образа жизни [1, 2, 12, 24, 26]. В большинстве случаев пациентам рекомендуют повысить уровень регулярной физической нагрузки, а также потребление жидкости до двух литров в сутки. Тем не менее контролируемых исследований, подтверждающих эффективность подобных рекомендаций у больных ХЗ, не существует [2].
В российских и зарубежных клинических рекомендациях сказано, что все пациенты с ХЗ должны придерживаться диеты, обогащенной клетчаткой [1, 27, 28]. Так, рекомендуется увеличение содержания в пищевом рационе пищевых волокон (ПВ) до 20–25 г в сутки [1, 2]. Эффективность такого подхода в популяциях пациентов с ХЗ и СРК-З показана в ряде систематических обзоров [29–31]. Следует отметить, что пшеничные отруби часто вызывают метеоризм, и до 50% пациентов самостоятельно прекращают их прием, что ограничивает использование ПВ при ХЗ [1]. Рациональным подходом является назначение препаратов или биологически активных добавок к пище на основе ПВ. Начало терапии ХЗ с увеличивающих объем кишечного содержимого слабительных наиболее физиологично, поскольку такой подход не изменяет природного механизма транзита и эвакуации [24]. При этом лечение ПВ требует приема достаточного количества жидкости для увеличения объема стула, стимуляции моторики и облегчения дефекации. Адекватная доза слабительного препарата в каждом конкретном случае строго индивидуальна и достигается постепенно [24, 32]. Действие ПВ реализуется в течение 12–72 часов, а положительный эффект – в течение 4–6 недель. Поэтому для оценки эффективности лечения необходим курс не менее двух месяцев [24, 33]. ПВ играют очень важную роль в изменении кишечной микробиоты, оказывая пребиотические эффекты, такие как стимулирование роста и/или функции полезных кишечных микроорганизмов [3].
Среди препаратов, содержащих натуральные ПВ, в рамках терапии ХЗ целесообразно применять псиллиум или частично гидролизованную гуаровую камедь (ЧГГК), представленную в России продуктом Оптифайбер.
Эффективность ЧГГК у пациентов с ХЗ и СРК-З продемонстрирована в ряде исследований [34–38]. При этом у пациентов с СРК-З помимо разрешения запора отмечался регресс абдоминальной боли, а также вздутия живота на фоне монотерапии ЧГГК [36–38]. В недавнем метаанализе семи исследований показано, что применение ЧГГК достоверно способствует превенции развития ХЗ (стандартизированная разность средних частоты актов дефекации до и после терапии: 0,58 раза в сутки; 95% ДИ 0,43–0,74) [39].
В клинических исследованиях наглядно продемонстрирована эффективность ЧГГК в рамках терапии СРК. G.C. Parisi и соавт. сравнивали положительные эффекты ЧГГК с рационом с высоким содержанием волокон, обычно применяемым при лечении СРК в клинических условиях. 188 пациентов были рандомизированы на две группы для назначения волокон или ЧГГК. Пациенты первой группы получали рацион с высоким содержанием волокон – 30 г/сут пшеничных отрубей, пациенты второй – напиток с ЧГГК в дозе 5 г/сут. ЧГГК добавляли в 60 мл напитка со вкусом яблока, который нужно было принимать утром, незадолго до завтрака. Через четыре недели пациентам, которые не были удовлетворены лечением, разрешали перейти в другую исследуемую группу. Почти половина пациентов группы ПВ перешла в группу ЧГГК (82,1% пациентов использовали возможность поменять группу). В то же время только 10 (10,9%) пациентов из группы ЧГГК перешли в группу ПВ (17,9% пациентов воспользовались возможностью поменять лечение). Авторы установили, что ЧГГК в дозе 5 г/сут нормализовала работу кишечника не только при запоре, но и при всех трех вариантах СРК – с преобладанием диареи (СРК-Д), преобладанием запора (СРК-З) и при изменчивой работе кишечника и уменьшило боль в животе: ЧГГК пациенты переносили лучше, чем рацион с высоким содержанием волокон. В период последующего наблюдения большинство больных решили перейти с лечения волокнами на прием ЧГГК. Частота положительного эффекта оказалась значимо выше в группе ЧГГК по сравнению с группой ПВ (почти 65 и 40% соответственно) [37].
Пребиотический эффект ЧГГК продемонстрирован в двух независимых исследованиях. Показано увеличение количества молочнокислых бактерий и Bifidobacterium spp. в кале после назначения препарата [34, 40]. При этом в исследовании с привлечением здоровых добровольцев были описаны состояния после двух недель приема ЧГГК. Интересно, что наряду с увеличением количества Bifidobacterium и Lactobacillus spp. наблюдалось уменьшение количества Clostridium spp., представителей семейств Enterobacteriaceae и Streptococcaceae [40].
Изучена еще одна интересная область применения ЧГГК – модуляция патологической кишечной микробиоты при синдроме избыточного бактериального роста в тонком кишечнике (СИБР). Так, в исследовании M. Furnari и соавт. 77 пациентов с диагностированным СИБР после дыхательного теста с 50 г глюкозы были рандомизированы на группы для назначения рифакcимина 1200 мг/сут или 1200 мг/сут плюс ЧГГК 5 г/сут в течение десяти дней. Пациенты заполняли опросник оценки симптомов и выполняли дыхательный тест с глюкозой исходно и через месяц после отмены терапии. Установлено, что комбинация ЧГГК с рифаксимином значимо более эффективна, чем только рифаксимин, в отношении эрадикации СИБР. Таким образом, на фоне применения комбинации уровень эрадикации достиг 87,1%, что значимо выше, чем показатель при использовании только рифаксимина (62,1%) [41].
Согласно национальным рекомендациям, при неэффективности модификации образа жизни и препаратов на основе ПВ у пациентов с ХЗ целесообразно использовать осмотические слабительные (полиэтиленгликоль, лактулозу, лактитол), а при рефрактерности – стимулирующие слабительные (бисакодил, пикосульфат натрия) [1]. Использование препаратов на основе сенны (листья кассии) нежелательно по причине не только известного свойства вызывать псевдомеланоз толстой кишки, но и отсутствия данных об эффективности. Как правило, в исследованиях, связанных с ХЗ, сенна изучается в комбинации с ПВ или другими препаратами. При длительном использовании не исключены нарушения электролитного и кислотно-щелочного баланса, повреждения подслизистых нервных сплетений толстой кишки [24, 42].
Заключение
Хронический запор является важнейшей глобальной медико-социальной проблемой. Согласно эпидемиологическим данным, эта патология регистрируется у четверти всей популяции экономически развитых стран и существенно снижает качество жизни больных. Модификация образа жизни и применение препаратов на основе пищевых волокон относятся к приоритетным инициальным направлениям в лечении пациентов с данным заболеванием.
Источник


