Медленно транзитный запор причины
Симптомы хронического запора
Признаки и симптомы хронического запора очевидны:
- менее 3 дефекаций в неделю
- значительные потуги при опорожнении кишечника
- жесткий стул
- неполное опорожнение кишечника
- неспособность дефекации
У пациентов, страдающих хроническим запором не наблюдается диарея, исключая случаи, связанные с использованием слабительных средств. Распространенность хронических запоров варьируется от 2 до 28%. Эпидемиологические исследования показывают, что возникновение запоров преобладает у людей в пожилом возрасте и чаще встречается у женщин, чем у мужчин.
Причины хронического запора
Существует множество различных причин возникновения хронического запора. Это состояние может возникнуть вследствие структурных повреждений толстой кишки:
- рак толстой кишки
- стриктура кишечника
А также в следствие различных заболеваний и других состояний, таких как:
- диабет
- заболевания щитовидной железы
- болезнь Паркинсона
- и в результате беременности (См. Запор при беременности)
Также, хронический запор может возникнуть в связи с приемом фармацевтических препаратов, таких как:
- обезболивающие средства
- препараты, снижающие кровяное давление (блокаторы кальциевых каналов)
- спазмолитики
В этих случаях, переход на новый препарат может улучшить симптомы. У людей, в возрасте свыше 50 лет, более серьезное заболевание кишечника или структурные изменения могут привести к возникновению запоров. Именно поэтому так важно обратиться к врачу для того, чтобы исключить какие-либо серьезные причины возникновения этого состояния.
Хронический запор, который возник вследствие «вторичных» причин, например, других заболеваний, патологических состояний или приема лекарственных средств, называют еще «функциональным запором».
Функциональный запор можно подразделить на три типа:
- Нормально-транзитный запор
- Медленно-транзитный запор
- Расстройства дефекации
При нормально-транзитном запоре, скорость прохождения каловых масс по толстой кишке находится в пределах нормы, но пациенты ощущают, что у них запор. Изменения в содержании воды в толстой кишке может также играть роль при этом типе запора.
При медленно-транзитном запоре, скорость прохождения каловых масс по толстой кишке замедленно.
Расстройства дефекации, которые могли вызвать возникновение запора включают диссинергическую дефекацию, выпадение прямой кишки (выпячивание тканей прямой кишки через анальное отверстие), и ректоцеле (выпячивание передней стенки прямой кишки). При диссинергической дефекации, также упоминаемой как тазовая дисфункция или анизмус, происходит нарушение координации мышц тазового дна, живота, ректальной области и анального сфинктера в механизме опорожнения кишечника.
По теме: Запор – что делать в домашних условиях? 6 путей решения.
Диагностика
Присутствие по крайней мере двух из шести следующих симптомов в течение последних 3 месяцев, говорит о наличии хронического запора:
- потуги при дефекации
- жесткий стул
- ощущение неполного опорожнения кишечника
- аноректальная обструкция
- применение манипуляций для облегчения дефекации
- менее 3 испражнений в неделю
Эти симптомы должны наблюдаться по меньшей мере 25% времени. Основным симптомом, наличие которого отличает функциональный запор от синдрома раздраженного кишечника (СРК) с запором, является боль в животе, преобладающая при СРК.
Идентификацию «вторичных» причин запора следует проводить, в частности, у пациентов, с некоторыми явными симптомами, указывающими на другие заболевания. Выявление вторичных причин показано если у вас наблюдается:
- беспричинное снижение массы тела
- кровь в испражнениях
- появление симптомов в возрасте после 50 лет
- если у вас в роду были случаи рака толстой кишки
Может быть показана такая диагностическая процедура, как колоноскопия (обследование толстой кишки). Медленно-транзитный запор может быть подтвержден несколькими специализированными процедурами, среди которых обследование толстой кишки с использованием рентген контрастных маркеров, радионуклидная сцинтиграфия и использование беспроводного кишечного радиозонда.
Расстройство дефекации может быть подтверждено с помощью аноректальной манометрии или дефекографии (рентгеновское исследование прямой кишки).
По теме: ТОП-5 народных средств от запора.
Лечение хронического запора
Важно понимать, что некоторые люди ходят в туалет реже, чем другие, и, если вы справляете большую нужду не каждый день, это может быть нормой для вашего организма. Если вы страдаете от надоедливых симптомов хронического запора, вам показана особая диета при запорах, с высоким содержанием клетчатки. При легкой форме запора рекомендуется дополнительно принимать добавки подорожника – это часто помогает облегчить прохождение каловых масс и нормализует дефекацию. Увеличение потребления жидкости и физические упражнения, как правило, рекомендуются, но их эффективность может быть не столь заметна.
При умеренных и тяжелых случаях запоров, обычно уже невозможно обойтись без лекарственных средств. Слабительные препараты могут помочь увеличить частоту дефекаций и смягчить жесткий стул. Лубипростон является активатором кальциевых каналов – он увеличивает электролит и секрецию жидкости в просвет толстой кишки, и ускоряет время прохождения каловых масс через кишечник, таким образом улучшая симптомы запора.
В случаях диссинергической дефекации, аноректальная БОС-терапия является наиболее эффективным методом лечения. В более тяжелых случаях выпадения прямой кишки и ректоцеле, может быть показана операция.
По теме: Как избавиться от запора в домашних условиях быстро.
Источник
Инертная толстая кишка (синонимы: хронический идиопатический запор, медленно-транзитный запор)— нарушение моторной функции толстой кишки, связанное соснижением скорости продвижения кишечного содержимого при отсутствии анатомических аномалий.
Основным клиническим проявлением инертной толстой кишки (ИТК) является хронический запор (ХЗ). Распространенность ИТК среди населения находится, по данным разных авторов, в пределах от 4% до 20% [1, 2]. Причиной медленного транзита служат структурные, механические, метаболические и кортиковисцеральные влияния на толстую кишку. Особенно тяжелые нарушения транзита развиваются при болезни Паркинсона, псевдообструкции, обусловленной системной нейропатией и селективной нейропатией толстой кишки.
При ИТК наблюдается снижение как фоновой моторики, так и стимулированной — после пищевой нагрузки и других раздражителей. В зависимости от типа ответа толстой кишки на стимулирующие воздействия мы выделяем три степени нарушения моторики при этом заболевании.
Степени нарушения моторной функции при ИТК [3]
1-й тип наблюдается при компенсированной стадии хронического колостаза. Он проявляется отсутствием гастроколического рефлекса и снижением амплитуды и длительности ответов на все виды воздействий.
2-й тип характеризуется отсутствием реакций на пищевую (нет гастроколического рефлекса) и механическую стимуляцию.
3-й тип (рефрактерный) — отсутствие реакции на пищевую, механическую и электрическую стимуляцию. Подобные нарушения указывают на тяжелые органические изменения в нервно-мышечном аппарате толстой кишки и могут являться показанием к хирургическому лечению в объеме колэктомии с наложением илеоректоанастомоза.
Длительный анамнез, отсутствие эффекта от использования пищевых добавок в адекватных количествах, слабительных средств и необходимость систематического очищения кишечника с помощью клизм дают все основания предполагать ИТК. Следует выяснить количество пищевых волокон и жидкости, потребляемых больными, а также режим питания. Клинические диагностические критерии ИТК сформулированы Римским консенсусом в 2006 г. [4].
Диагностические критерии ИТК в соответствии с Римским консенсусом 2006 г. [4]
Пациент должен соответствовать критериям диагностики функционального запора (Рим III, 2006 г.). Любые 2 из 6 пунктов:
1. Натуживание при дефекации.
2. «Овечий» или твердый стул.
3. Ощущение неполноценности дефекации.
4. Ощущение аноректальной обструкции (блокады).
5. Помощь при дефекации руками.
6. Менее 3 дефекаций в неделю.
Критерии 1, 2, 3, 4, 5 присутствуют не менее чем в 25% дефекаций, появились не ранее чем 6 мес. назад и проявляются последние 3 мес.
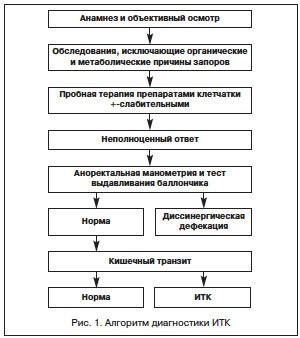
Алгоритм обследования должен включать функциональные исследования кишечника: аноректальную манометрию (АРМ), тест выдавливания баллончика и определение времени кишечного транзита с помощью рентгеноконтрастной тест-системы. На рисунке 1 показан алгоритм диагностики ИТК.
При сомнительном результате АРМ предлагается проведение дефекографии.
Основным функциональным методом, подтверждающим ИТК, является определение времени транзита. Исследование кишечного транзита проводится с помощью рентгеноконтрастной тест-системы. Пациенту предлагают принять внутрь 20 рентгеноконтрастных маркеров. Спустя 120 ч выполняют обзорную рентгенограмму брюшной полости. Критерием нарушения моторно-эвакуаторной функции является присутствие 5 и более маркеров в просвете толстой кишки, также, оценивая расположение маркеров, можно судить о кологенной (ИТК) и проктогенной (диссинергическая дефекация — ДД) причине запора. При ДД маркеры располагаются преимущественно в ампуле прямой кишки и дистальных отделах сигмовидной, тогда как при ИТК распределены по всем отделам толстой кишки, включая ее правые отделы.
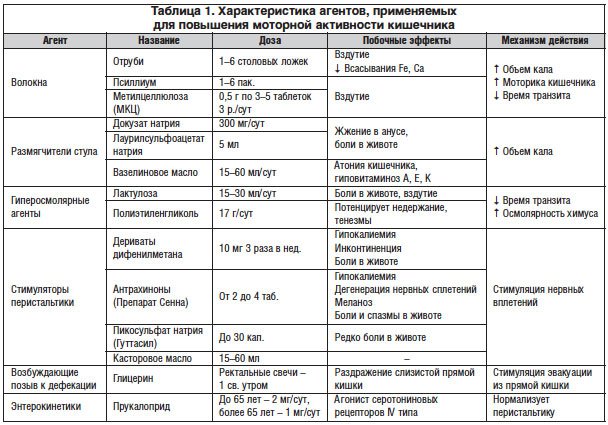
Традиционно сложившийся взгляд на связь запоров с недостатком клетчатки [4] является непреложным условием увеличения потребления клетчатки в качестве начальной терапии хронических запоров любой этиологии. Нерастворимые волокна, такие как пшеничные отруби, как полагают, уменьшают время кишечного транзита, тем самым увеличивая частоту стула [5]. Растворимые волокна, например семена подорожника, растворяясь в воде, увеличивают объем и частоту стула [6]. Проведенные в последующие десятилетия многочисленные исследования, в т. ч. и рандомизированные, показали, что одними диетическими мероприятиями и изменением образа жизни проблему лечения и профилактики ИТК не решить. Для патогенетического влияния на сниженную моторную активность толстой кишки используют стимуляторы перистальтики, гиперосмолярные агенты, а в случае затяжного или рефрактерного течения — энтерокинетики (табл. 1).
Цель настоящей работы — установление частоты ИТК и эффективности пикосульфата натрия (Гуттасила) у больных первичными ХЗ.
Материал и методы
Проведено обследование 132 больных первичным ХЗ в возрасте от 18 до 89 лет, поступивших на лечение в МКНЦ. Критериями исключения являлись вторичные ХЗ и психические заболевания. Среди больных преобладали женщины — 121 (91,6%). Пациенты соответствовали критериям функционального запора (ФЗ) (Римские критерии III). Частота стула составляла у всех менее 3-х раз в неделю. У 119 (90%) человек отмечался твердый стул (тип 1–2 по Бристольской шкале). Более половины — 76 (57%) — жаловались на ощущение неполного опорожнения прямой кишки, 60 (45%) — на отсутствие позывов к дефекации, 92 (69%) — на трудность дефекации. У 7 (5,3%) больных для дефекации требовалось ручное вспоможение.
Всем больным проводили проктологическое исследование, колонофиброскопию, эзофагогастродуоденоскопию (ЭГДС) и ультразвуковое исследование органов брюшной полости. Выполняли также тест выдавливания баллона. В прямую кишку вводили баллончик, который наполняли водой до объема 50 мл, после чего пациенту предлагалось вытолкнуть его в течение 5 мин. Также выполняли АРМ с помощью 8-канальноговодно-перфузионного аппарата Solar GI, MMS. Пациентам, у которых не подтверждалась ДД, проводили исследование кишечного транзита с помощью 20 рентгеноконтрастных маркеров.
Результаты и обсуждение
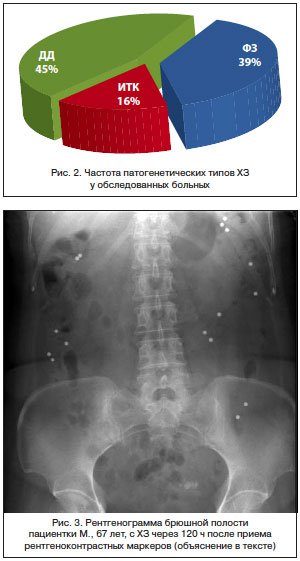
Результаты исследования показаны на рисунке 2. У 51 из 132 (39%) больных время транзита по толстой кишке и показатели АРМ не выходили за пределы нормы.
Поэтому в соответствии с Римскими критериями III (2006 г.) у них установлен первый тип ХЗ — функциональный запор, связанный с дискинезией кишечника. У 59 (45%) больных ХЗ выявлена ДД, т. е. третий тип ХЗ. У 25 (39%) пациентов с выявленной ДД время выдавливания баллона превышало 5 мин, что подтверждало выраженное нарушение механизма дефекации. У 21 (16%) пациента подтверждена ИТК, т. е. второй тип ХЗ (в просвете кишки осталось более 5 маркеров с преимущественным расположением в нисходящей, сигмовидной и прямой кишке, у 5 из них маркеры находились также в восходящей и поперечной ободочной кишке).
Всем пациентам с 1-м типом ХЗ назначали медикаментозную терапию с применением пищевых волокон, регуляторов моторики, а при смешанной форме — минимальные дозы нейролептиков.
Пациентам с выявленной ДД, помимо общих рекомендаций по лечению и профилактике запоров, предлагали курс биофидбек-терапии. Он заключался в обучении пациента расслаблять аноректальные мышцы под собственным визуальным контролем с использованием аппарата Solar GI, MMS.
Для лечения 21 пациента с ИТК, помимо общих рекомендаций по диете, водной нагрузке и приему клетчатки, с целью стимуляции перистальтики к терапии назначали пикосульфат натрия (Гуттасил) в начальной дозе 15 кап./сут. В дальнейшем пациент мог менять дозу препарата на 2–5 кап./сут, добиваясь нормального стула. Максимальная доза составляла 27 капель.
Пикосульфат натрия (Гуттасил) стимулирует рецепторы слизистой оболочки кишечника, усиливает перистальтику. Активная форма препарата, образующаяся путем гидролиза под влиянием кишечных микроорганизмов, непосредственно возбуждает нервные структуры кишечной стенки, в результате ускоряется продвижение кишечного содержимого, уменьшается всасывание электролитов и воды. Слабительный эффект наступает через 6–12 ч после приема. При приеме внутрь не всасывается из ЖКТ и не подвергается печеночно-кишечной циркуляции.
Для достижения ежедневного стула 5 пациентам потребовалось 20 капель (9–25 кап.), у 5 больных на максимальной дозе 27 кап. в сутки самостоятельный стул отмечался через каждые 2–3 дня. У 2 пациентов на фоне приема максимальной дозы 27 кап. частота стула сохранялась менее 3 раз в неделю, что послужило основанием для назначения прукалоприда в дозе 2 мг/сут.
Всем больным требовался систематический прием Гуттасила для сохранения нормального стула. В дальнейшем 4 пациентам удалось уменьшить дозу до 15 кап. в сутки.
Таким образом, применение Гуттасила у 14 пациентов с ИТК и отсутствием самостоятельного стула позволило добиться ежедневной дефекации, а у 5 пациентов — 1 раз в 2–3 дня. Приводим одно из клинических наблюдений.
Больная М., 67 лет, поступила в отделение заболеваний кишечника МКНЦ 14.09.2014 г. с жалобами на запоры, вынуждающие регулярно использовать слабительные препараты и очистительные клизмы, твердый стул (тип 1–2 по Бристольской шкале), трудную дефекацию.
Запорами страдает с 20 лет, последние 6 лет стул только с помощью слабительных препаратов и очистительных клизм. В январе 2014 г. госпитализирована в районную больницу в связи с болями в животе и отсутствием самостоятельного стула. При ирригоскопии патологии не выявлено, при ЭГДС — поверхностный гастрит. Проводилась терапия слабительными препаратами, на фоне которых запоры сохранялись. Рекомендовано дальнейшее обследование в МКНЦ.
Данные осмотра: общее состояние удовлетворительное. Телосложение нормальное. Рост 158 см. Вес 78 кг. ИМТ — 31,2 кг/м2, ожирение 1-й степени.
Клинический и биохимический анализы крови без патологических значений. УЗИ органов брюшной полости: деформация желчного пузыря. Ректороманоскопия и колоноскопия с осмотром 15 см дистального отдела подвздошной кишки — без патологии.
По результатам АРМ, данных, свидетельствующих о ДД и других нарушениях дефекации, не получено. Для оценки моторики толстой кишки проведено исследование кишечного транзита с помощью рентгеноконтрастной тест-системы. Пациентке предложено принять внутрь 20 рентгеноконтрастных маркеров. Спустя 120 ч выполнена обзорная ренгенограмма брюшной полости: в просвете толстой кишки осталось 16 маркеров из 20, что подтверждает нарушение моторно-эвакуаторной функции толстой кишки, а распределение маркеров по разным отделам толстой кишки соответствует ИТК (рис. 3).
Пациентке назначен пикосульфат натрия (Гуттасил) в дозе 15 кап./сут. В процессе лечения она постепенно увеличила дозу до 25 кап./сут. На фоне поддерживающей терапии у нее сохраняется самостоятельный стул 2–3 раза в неделю, без дополнительного использования очистительных клизм.
Таким образом, для лечения пациентки М. с патогенетически обоснованной ИТК терапия пикосульфатом натрия (Гуттасил) оказалась достаточно эффективной.
Заключение
Диагноз ИТК должен устанавливаться в последовательности предлагаемого алгоритма с соблюдением Римских критериев. Ведущую роль в диагностике ИТК играют функциональные методы исследования — АРМ, тест выдавливания баллончика и определение времени транзита по толстой кишке с помощью рентгеноконтрастных маркеров. В лечении ИТК основное значение принадлежит энтерокинетикам, но определенную роль могут играть и слабительные, стимулирующие перистальтику (Гуттасил), а также гиперосмолярные агенты и пищевые волокна.
Источник
- Архив журнала
/ - 2010
/ - №15
Идиопатический медленно-транзитный запор: механизмы развития и возможности лечения
Белоусова Е.А.
Рассматриваются особенности идиопатического медленно-транзитного запора (ИМТЗ) неизвестной этиологии (российский синоним – хронический толстокишечный стаз), представляющего собой отдельное заболевание, отличающееся от синдрома раздраженного кишечника, симптоматических, проктогенных и других вариантов запора. ИМТЗ характерен в основном для женщин (70–80 %), начинается в раннем детском или подростковом возрасте, продолжается всю жизнь и очень плохо отвечает на любые попытки медикаментозной коррекции. Обсуждается патофизиология ИМТЗ, в которой важную роль играет дисбаланс регуляторных кишечных пептидов и медиаторов, включая опиоиды (энкефалины и эндорфины). Подчеркивается, что единственный реально доступный препарат, стимулирующий двигательную активность толстой кишки, тримебутин (Тримедат), – полный агонист всех трех типов опиатных рецепторов. Имеющиеся клинические данные свидетельствуют о положительном терапевтическом действии тримебутина на различные функции желудочно-кишечного тракта, в т. ч. указывают на его способность стимулировать активность гладкой мускулатуры толстой кишки при ИМТЗ.
Литература
1. Murray C, Emmanuel A. Colonic Disorders. p. 148160. In:Pathophysiology of the Enteric Nervous System. Ed. Spiller R, Grundy D. Blackwell, 2004.
2. Kamm MA, Lennard-Jones JE. Colonic motor activity in constipation. Constipation 1994:65–72.
3. Peracchi M, Basilisco G, Tagliabue R, et al. Postprandial Gut Peptide Plasma Levels in Women with Idiopathic Slow-Transit Constipation. Scand J Gastroenterol 1999;34(1):25–28.
4. Белоусова Е.А. Возможности лечения запора у пожилых пациентов // Врач 2002. № 5. С. 47–49.
5. Кукес В.Г. Клиническая фармакология. М., 2006.
6. Белоусова Е.А., Румянцев В.Г., Мишуровская Т.С. Новые возможности сандостатина (октреотида) в гастроэнтерологии //Клиническая фармакология и терапия 2000. № 1. С. 16–19.
7. Lluis F, Thompson JC. Neiroendocrine Potential of the Colon and Rectum. Gastroenterology 1988;94:832–44.
8. Milner P, Burnstock G, Kamm MA, et al. Neurotransmitters in the gut Constipation 1994:41–49.
9. Maselli MA, Riezzo G, Pezzolla F. Motor responsiveness of proximal and distal human colonic muscle layers to carbachol and neurotensin. Dig Dis Sci 1998;43(8):1685–89.
10. Akkermans LMA, van der Heide D, Kamm MA et al. Metabolic and endocrine factors in constipation. Constipation 1994:59–64.
11. Bueno L, Fioramonti J, Kamm MA, et al. Central control of colonic motility: possible involvement in constipation. Constipation 1994:51–58.
12. Gyr R, Meier R. Pharmacodynamic effects of Sandostatin in the gastrointestinal tract. Digestion 1993;54(1):14–19.
13. Овсянников В.И. Нейромедиаторы и гормоны в желудочно-кишечном тракте. СПБ. 2003. С. 136.
14. Peracchi M, Basilisco G, Tagliabue R, et al. Postprandial Gut Peptide Plasma Levels in Women with Idiopathic Slow-Transit Constipation. Scand J Gastroenterol 1999;34(1):25–28.
15. Sijp van der JRM, Kamm MA,Nightigale JMD, et al. Circulating gastrointestinal hormone abnormalities in patients with severe idiopathic constipation. Amer J Gastroenterol 1998; 93(8):1351–56.
16. Christensen J, Kamm MA, Lennard-Jones JE. Morphology of the innervation of large intestine and the neuropathology of constipation. Constipation 1994:33–40.
17. Cortesini C, Cianchi F, Infantino A, et al. Nitric oxide syntheses and VIP distribution in enteric nervous system in idiopathic constipation. Dig Dis Sci 1995;40(11):2450–55.
18. Corbett A, McKnight S, Henderson G. Opioid Receptors. Pub. 1999. Scientific Reviews. Torcis bioscience. www.torcis.com Delvaux M, Wingate D. Trimebutine: mechanism of action, effects on gastrointestinal function and clinical results. J Int Med Res 1997;25(5):225–46.
19. Holzer Р. Opioid receptors in the gastrointestinal tract. Regulatory Peptides 2009;155(1–3):11– 13.Taguchi АК, Sharma N, Saleem RM, et al. Selective postoperative inhibition of gastrointestinal opioid receptors. N Engl J Med 2001;345:13.
20. Holzer Р. Opioids and opioid receptors in the enteric nervous system: from a problem in opioid analgeto a possible new prokinetic therapy in humans. Neuroscience Lettersю 2004;361 (1-3):192–195.
21. DeHaven-Hudkins DL, DeHaven RN, Little PJ, et al. The involvement of the mu-opioid receptor in gastrointestinal pathophysiology: therapeutic opportunities for antagonism at this receptor. Pharmacol Ther. 2008;117(1):162–87.
22. Kraft MD. Methylnaltrexone, a new peripherally acting mu-opioid receptor antagonistbeing evaluated for the treatment of postoperative ileus. Expert Opin Investig Drugs 2008;17(9):1365–77.
23. Neyens R, Jackson KC. Novel opioid antagonists for opioid-induced bowel dysfunction and postoperative ileus. J Pain Palliat Care Pharmacother 2007;21(2):27–33.
24. Liu BH, Mo P, Zhang SB. Effects of mu and kappa opioid receptor agonists and antagonists on contraction of isolated colon strips of rats with cathartic colon. World J Gastroenterol 2004;10(11):1672–74.
25. Ивашкин В.Т., Драпкина О.М. Современные возможности применения тримебутина в лечении хронической абдоминальной боли //РЖГГК 2008. № 5. С. 12–16.
26. Kountouras J. Efficacy of trimebutine therapy in patients with gastroesophageal reflux disease and irritable bowel syndrome. Hepatogastroenterology 2002;49(43):193–97.
27. Тропская Н.С., Попова Т.С. Механизм действия тримебутина в коррекции функциональных расстройств желудочно-кишечного тракта. Клиническая гастроэнтерология и гепатология // Русское издание. 2008. Т. 1. № 4. С. 1–4.
28. Aktas А, Caner В, et al. The effect of trimebutine maleate on gastric emplying in patients with non- ulcer dyspepsia. Аnnals of nuclear Medicine 1999;13(4):231–34.
29. Zhong YO, Zhu J, Guo JN, et al. Рандомизированное клиническое исследование методом случай–контроль при лечении тримебутина малевтом функциональной диспепсии, сопровождающейся синдромом раздраженного кишечника с диареей // Клиническая гастроэнтерология и гепатология. Русское издание. 2008. Т. 1. № 4. С. 5–8.
30. Barthet M. Effect of trimebutine on of Oddi motility in patients with post-cholecystectomy pain. Aliment Pharmacol Ther 1998l;12(7): 647–52.
31. Schang JC, Devroede G, Pilote M. Effects of trimebutine on colonic function in patients with chronic idiopathic constipation: evidence for the need of a physiologic rather than clinical selection. Dis Colon Rectum 1993;36(4):330–36.
Похожие статьи
- Возможности купирования боли при синдроме раздраженного кишечника
- Прогностическое значение длительного использования селективных М3-холинолитиков больными синдромом раздраженной кишки
- Сравнительная эффективность препаратов Необутин® Ретард, таблетки пролонгированного действия, покрытые пленочной оболочкой, 300 мг, и Тримедат®, таблетки 200 мг, у больных синдромом раздраженного кишечника
- Синдром раздраженного кишечника: критерии диагностики и подходы к терапии
- Эффективность комплексной терапии с включением препарата Адепресс (пароксетин) у больных синдромом раздраженного кишечника
Источник

